இரும்பின் உலோகவியல்
இரும்பின் உலோகவியல்:
குறியீடு : Fe
நிறம் : சாம்பல் வெண்மை.
அணு நிறை : 55.9
அணு எண்: 26
எலக்ட்ரான் அமைப்பு : 2,6, 14, 2
இணைதிறன் : 2,3
இரும்பின் உலோக மூலங்கள்:
அலுமினியத்தை அடுத்து பெருமளவில் கிடைக்கும் இரண்டாவது உலோகம் இரும்பு. இது ஆக்சைடாக, சல்பைடாக, கார்பனேட்டாக இயற்கையில் கிடைக்கிறது.
இரும்பின் தாதுக்களாவன.
1. ஹேமடைட் - Fe2O3
2. மேக்னடைட் - Fe3O4
3. இரும்பு பைரைட் - FeS2.
ஹேமடைட் (Fe2O3) தாதுவிலிருந்து இரும்பைப் பிரித்தெடுத்தல்:
1.புவியீர்ப்பு முறையில் அடர்பித்தல்:
ஹேமடைட் ஒரு ஆக்சைடு தாது. இது புவியீர்ப்பு முறையில் அடர்பிக்கும்போது இலேசான தூசுக்களும், மாசுக்களும் அகற்றப்பட்டு கடினமான துகள்கள் கீழே படிகின்றன.
2. வறுத்தல் மற்றும் நீற்றுதல் :
காற்றுள்ள சூழலிலும், காற்றில்லாச் சூழலிலும் வறுத்தல் தாதுவில் ஏற்படுத்தும் இந்நிகழ்வு ஈரப்பதம், சல்பர், ஆர்சனிக், பாஸ்பரஸ் முதலான மாசுக்கள் ஆக்ஸிஜனேற்றம் அடைந்து அகற்றப்படுகின்றன.
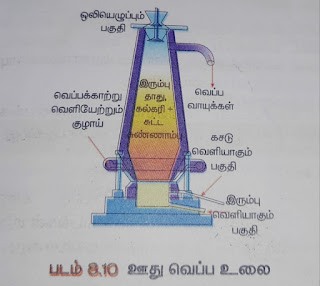
3. ஊது உலையில் உருக்கிப் பிரித்தல்:
குறியீடு : Fe
நிறம் : சாம்பல் வெண்மை.
அணு நிறை : 55.9
அணு எண்: 26
எலக்ட்ரான் அமைப்பு : 2,6, 14, 2
இணைதிறன் : 2,3
இரும்பின் உலோக மூலங்கள்:
அலுமினியத்தை அடுத்து பெருமளவில் கிடைக்கும் இரண்டாவது உலோகம் இரும்பு. இது ஆக்சைடாக, சல்பைடாக, கார்பனேட்டாக இயற்கையில் கிடைக்கிறது.
இரும்பின் தாதுக்களாவன.
1. ஹேமடைட் - Fe2O3
2. மேக்னடைட் - Fe3O4
3. இரும்பு பைரைட் - FeS2.
ஹேமடைட் (Fe2O3) தாதுவிலிருந்து இரும்பைப் பிரித்தெடுத்தல்:
1.புவியீர்ப்பு முறையில் அடர்பித்தல்:
ஹேமடைட் ஒரு ஆக்சைடு தாது. இது புவியீர்ப்பு முறையில் அடர்பிக்கும்போது இலேசான தூசுக்களும், மாசுக்களும் அகற்றப்பட்டு கடினமான துகள்கள் கீழே படிகின்றன.
2. வறுத்தல் மற்றும் நீற்றுதல் :
காற்றுள்ள சூழலிலும், காற்றில்லாச் சூழலிலும் வறுத்தல் தாதுவில் ஏற்படுத்தும் இந்நிகழ்வு ஈரப்பதம், சல்பர், ஆர்சனிக், பாஸ்பரஸ் முதலான மாசுக்கள் ஆக்ஸிஜனேற்றம் அடைந்து அகற்றப்படுகின்றன.
3. ஊது உலையில் உருக்கிப் பிரித்தல்:
வறுக்கப்பட்ட தாது, கல்கரி, சுண்ணாம்புக்கல் இவற்றை 8: 4: 1 என்ற விகிதத்தில் எடுத்து உலையில் மேலுள்ள கிண்ணக்கூம்பு அமைப்பு வழியாகச் செலுத்தும்போது மூன்று பகுதிகளில் மாற்றங்கள் நிகழ்கின்றன.
அ. கீழ்ப்பகுதி (அ) அடிப்பகுதி :
(எரி மண்டலம்)
1500 டிகிரி செல்சியஸ் வெப்பநிலையில் தாதுக்கலவை வெப்பக் காற்றுடன் சேறும்போது கல்கரி ஆக்ஸிஜனுடன் எரிந்து CO2 வாக மாறுகிறது.
1500 ゜c
C + O2 ➡ CO2 + வெப்ப ஆற்றல்
இவ்வினையிலிருந்து வெப்ப ஆற்றல் வெளியாவதால், இது " வெப்ப உமிழ்வினை" எனப்படும்.
ஆ. நடுப்பகுதி (அ) மத்தியப் பகுதி: (உருக்கு மண்டலம்)
1000 ゜c வெப்பநிலையில் இப்பகுதியில் நடைபெறும் வினைகள்.
1000゜c
CO2 + C ➡ 2CO - வெப்ப ஆற்றல்.
சுண்ணாம்புக்கல் சிதைந்து கால்சியம் ஆக்சைடையும் CO2 வையும் தரும்.
CaCO3 ➡ CaO + CO2 - வெப்ப ஆற்றல்.
மேற்கண்ட இருவினைகளும், "வெப்பக் கொள்வினைகளாகும்".
கால்சியம் ஆக்சைடு சிதைந்து மணலுடன் சேர்ந்து கால்சியம் சிலிகேட் என்னும் கசடாகிறது.
CaO + SiO2 ➡ CaSiO2.
இ. மேற்பகுதி:(ஒடுக்கு மண்டலம்)
400゜c வெப்பநிலையில் இப்பகுதியில் ஃபெரிக் ஆக்சைடு கார்பன் மோனாக்சைடு மூலம் இரும்பாகக் குறைக்கப்படுகிறது.
400゜c
Fe2O3 + 3CO ➡ 2Fe + 3CO2.
கசடை நீக்கிய பிறகு, உருகிய இரும்பு உலையின் அடியில் சேகரிக்கப்படுகிறது.இந்த இரும்பு விதவித அச்சுகளில் வார்க்கப்படுவதால் இது "வார்ப்பிரும்பு" எனப்படும்.
இயற்பண்புகள்:
🎂 இது கனமான உலோகம்.
🎂 இதன் அடர்த்தி 7.9 g/ cc
🎂 பளபளப்பான உலோகம்.
🎂 சாம்பல் நிறமுடையது.
🎂 இழுவிசையும், தகடாகும் தன்மையும், கம்பியாகும் தன்மையும் கொண்டது.
🎂 வெப்பத்தையும், மின்சாரத்தையும் நன்கு கடத்தும்.
🎂 காந்தமாகும் தன்மையுடையது.
வேதிப்பண்புகள் :
1. காற்றுடன் வினை :
இரும்பு காற்றுடன் வினைபுரிந்து மேக்னடிக் ஆக்சைடு உருவாகிறது.
3Fe + 2O2 ➡ Fe3O4 (கறுப்பு நிறம்)
2. ஈரக்காற்றுடன் வினை:
இரும்பு ஈரக்காற்றுடன் வினைபுரிந்து அதன் பரப்பில் பழுப்பு நிற நீரேறிய இரும்பு (III) ஆக்சைடு உருவாகிறது. இதுவே "துரு" எனப்படும். இந்நிகழ்ச்சி " துருப்பிடித்தல்" எனப்படும்.
4Fe + 3O2 + H2O ➡ 2Fe2O3● xH2O(துரு).
3. நீராவியுடன் வினை :
செஞ்சூடேற்றப்பட்ட இரும்பு நீராவியுடன் வினைபுரிந்து மேக்னடிக் ஆக்சைடு உருவாகிறது.
3 Fe + 4H2O(நீராவி) ➡ Fe3O4 + 4H2 ⬆.
4. குளோரினுடன் வினை :
இவ்வினையில் ஃபெரிக் குளோரைடு உருவாகிறது
2Fe + 3Cl2 ➡ 2FeCl3
5. அமிலங்களுடன் வினை:
நீர்த்த HCl, நீர்த்த H2SO4 அமிலங்களுடன் வினைபுரிந்து ஹைட்ரஜன் வாயு உருவாகிறது.
Fe + 2HCl ➡ FeCl2 + H2 ⬆
Fe + H2SO4 ➡ FeSO4 + H2 ⬆
நீர்த்த HNO3 அமிலத்துடன் வினைபுரிந்து ஃபெரஸ் நைட்ரேட் உருவாகிறது.
4Fe+10HNO3 ➡ 4Fe(NO3)2 +NH4NO3+ 3H20
அடர் H2SO4 அமிலத்துடன் வினை :
2Fe + 6H2SO4 ➡ Fe2(SO4)3 + 3SO2 + 6H2O.
அடர் HNO3 அமிலத்துடன் வினை :
இவ்வினையில் இரும்பு ஆக்சைடு (Fe3O4) படலம் உருவாவதால் இரும்பு தன்வினைதிறனை இழக்கின்றது.
கார்பன் அளவைப் பொருத்து இரும்பை மூன்றாகப் பிரிக்கலாம்.
1. வார்ப்பிரும்பு (2% - 4.5% கார்பன்)
2. எஃகு இரும்பு (0.25% - 2% கார்பன்)
3. தேனிரும்பு (<0.25% கார்பன்).
பயன்கள்:
1. வார்ப்பிரும்பு :
கழிவுநீர்க் குழாய்கள், அடுப்புகள், தண்டவாளங்கள், சாக்கடை மூடிகள் செய்மப் பயன்படுகிறது.
2. எஃகு :
கட்டிடங்கள், எந்திரங்கள், தொலைக்காட்சிக் கோபுரங்கள், மின்கடத்துக் கம்பிகள் செய்யப் பயன்படுகிறது.
3. தேனிரும்பு:
கம்பிச்சுருள், மின்காந்தம், நங்கூரம் செய்யப் பயன்படுகிறது.

கருத்துகள்
கருத்துரையிடுக